L’atomo è la più piccola parte di un elemento. Ciascun elemento contiene solo ed esclusivamente atomi dello stesso tipo. Per esempio l’elemento ossigeno è formato solo da atomi di ossigeno. In natura esistono 92 elementi chimici e dunque vi sono 92 tipi di atomi.
La struttura dell’atomo
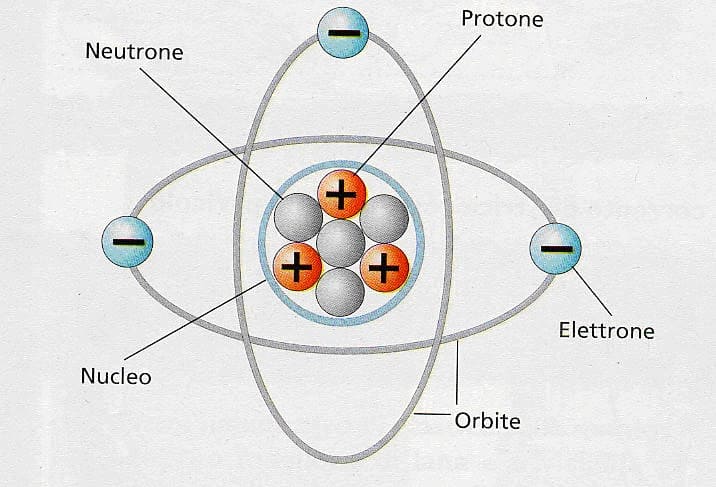
L’atomo ha al centro un nucleo. Il nucleo contiene una o più particelle elettricamente neutre, i neutroni, e particelle cariche positivamente, i protoni.
Distribuite attorno al nucleo ci sono invece particelle cariche negativamente, gli elettroni, ciascuna con una carica uguale e opposta a quella del protone ma con massa molto inferiore.
Le proprietà chimiche di un atomo sono determinate dal numero e dalla distribuzione dei suoi elettroni intorno al nucleo.
Gli elementi si distinguono in base al numero atomico
Un elemento si distingue dagli altri per il numero di protoni presenti in ciascuno dei suoi atomi. Tale numero, detto numero atomico (Z), è costante e caratteristico di ciascun elemento.
Per esempio, un atomo di idrogeno, l’elemento più semplice, ha un solo protone nel suo nucleo (numero atomico = 1); invece un atomo di carbonio ne ha sei (numero atomico = 6).
In ogni atomo il numero di elettroni è uguale al numero dei protoni: pertanto ogni atomo risulta elettricamente neutro.
Cosa sono gli isotopi
Tutti gli atomi di un determinato elemento hanno lo stesso numero di protoni nei loro nuclei (e quindi lo stesso numero atomico), ma possono contenere un numero differente di neutroni; in tal caso le diverse varianti sono dette isotopi dell’elemento. Poiché il numero dei protoni (e di conseguenza degli elettroni) è lo stesso, le proprietà chimiche sono uguali per tutti gli isotopi di un elemento.
Il numero di massa
Il numero di massa (A) di un atomo corrisponde alla somma dei protoni e dei neutroni presenti nel nucleo. Il nucleo di un atomo di carbonio contiene 6 protoni e 6 neutroni, quindi il suo numero di massa è 12; l’ossigeno ha 8 protoni e 8 neutroni, quindi un numero di massa pari a 16.
Massa atomica relativa o peso atomico
Con massa atomica relativa (o peso atomico), invece, si indica la massa media di un elemento, che tiene conto dei vari isotopi. Gli elettroni, infatti, sono così leggeri in confronto ai protoni e ai neutroni che la loro massa è trascurabile. Ad esempio, quando ci pesiamo soltanto circa 30 grammi della nostra massa totale (che è la somma della massa di tutti gli atomi che formano il nostro corpo) sono dovuti agli elettroni.
L’atomo è costituito principalmente da spazio vuoto
Gli atomi sono costituiti principalmente da spazio vuoto. Nell’atomo di idrogeno, per esempio, la distanza fra il nucleo e l’unico elettrone è, mediamente, circa 1000 volte il diametro del nucleo stesso.